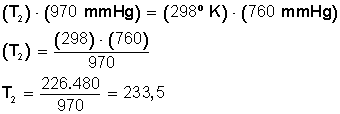LEY DE GAYY-LUSSAC
Esta ley establece la relación entre la presión (P) y la temperatura (T) de un gas cuando el volumen (V) se mantiene constante, y dice textualmente:
La presión del gas es directamente proporcional a su temperatura.
Esto significa que:
Si aumentamos la temperatura, aumentará la presión.
Si disminuimos la temperatura, disminuirá la presión.
Si lo llevamos al plano matemático, esto queda demostrado con la siguiente ecuación:
la cual nos indica que el cociente entre la presión y la temperatura siempre tiene el mismo valor; es decir, es constante.
Llevemos esto a la práctica y supongamos que tenemos un gas, cuyo volumen (V) no varía, a una presión P1 y a una temperatura T1. Para experimentar, variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y tendrá que cumplirse la siguiente ecuación:
que es la misma Ley de Gay-Lussac expresada de otra forma.
Debemos recordar, además, que esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta, y tal como en la Ley de Charles, las temperaturas han de expresarse en grados Kelvin.
Veamos un ejemplo:
Tenemos un cierto volumen de un gas bajo una presión de 970 mmHg cuando su temperatura es de 25° C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución:
Lo primero que debemos hacer es convertir los 25º C a grados Kelvin:
T1 = (25 + 273) K= 298 K
Ahora sustituimos los datos en la ecuación:
Ahora despejamos T2:
Respuesta:
La temperatura debe bajar hasta los 233,5º Kelvin. Si convertimos estos grados en grados Celsius hacemos
233,5 − 273 = −39,5 °C.
Ley general de los gases o ecuación general de los gases
Las leyes parciales analizada precedente mente pueden combinarse y obtener una ley o ecuación que relaciones todas las variables al mismo tiempo.
Según esta ecuación o ley general
Esto significa que, si tenemos una cantidad fija de gas y sobre la misma variamos las condiciones de presión (P), volumen (V) o temperatura (T) el resultado de aplicar esta fórmula con diferentes valores, será una constante.
Veamos un ejemplo, para aclarar:
Supongamos que tenemos una cierta cantidad fija de un gas (n1), que está a una presión (P1), ocupando un volumen (V1) a una temperatura (T1).
Estas variables se relacionan entre sí cumpliendo con la siguiente ecuación:
Donde R es una constante universal conocida ya que se puede determinar en forma experimental.
La misma fórmula nos permite calcular el volumen molar de un gas (n):